スタッフブログ
2025.02.17
子牛の輸液療法について4(輸液時の注意点)
これまで輸液療法を行うための意義や、子牛の状態の評価方法、輸液選択について説明してきました。静脈投与はあくまでも子牛自身が自ら飲むことができなくなってしまった場合の最終手段です。特に今のような冬場は下痢の子牛が増えてしまったりすることで、静脈内への輸液の機会が増えてくる時期であると思います。しかし、そういった輸液を行う場合に、合併症を引き起こしてしまう場合があります。その際の見ておくべき注意点について今回は説明していこうと思います。
農場の方に一番気を付けてほしいこと
長時間の輸液によっておこる問題の多くは子牛の観察不足によっておこります。例としては、輸液がなくなり凝固してしまう、ラインがねじれてしまい、閉塞してしまう等があげられます。長期にわたるライン維持は難しいため経口投与が望ましいです。
合併症について
低体温症
24時間以上吸乳反射が無い、下痢、脱水にある子牛では低体温が問題になります。さらに、寒い状況下での大量輸液は低体温を助長するため、できれば建物内等の暖かい環境下で輸液を行うことが望ましいです。寒い状況下では、輸液剤を温めていても長時間の輸液を行う場合低体温症を避けることは難しいです。
水分過剰
輸液が急速に投与し、血管内圧が上がることで肺水腫等の合併症を引き起こします。臨床兆候は、鼻汁、呼吸促拍、頻脈、咳、湿性の肺音があげられます。水分過剰による、肺、間質、脳浮腫の発生を防ぐためには80ml/kg/hより遅い速度が望ましいです。(50kgの子牛に対し1時間で4L以下)
貧血や低タンパク血症も起こり、血球容積15%以下で低酸素総タンパク質が4mg/dL以下でこれらの合併症が起こります。耳介静脈からの輸液において流量が制限されるため起こる可能性が低いとされています。
2025.02.17
子牛の輸液療法について3(輸液の選択)
輸液の選択
輸液というと静脈に留置を入れることが一番イメージがしやすいと思いますが、経口で与える電解質も輸液療法の一つです。実際に自家治療を行っていく上で正しい選択ができるようこの章では説明していきます。
農場における簡易プロトコル
今回参考にした文献の著者が実際に使用しているプロトコルの簡易版についてです。
子牛が下痢を引き起こしている場合、重炭酸により体内のアシドーシスをコントロールする必要があります。子牛の場合8日未満の子牛のアシドーシスは重症化しないことが多く治療においても日齢を考える必要があります。
重炭酸イオン必要量=体重㎏×塩基欠乏mEq/L×0.5~0.6L/Kg
これが必要量の計算になりますが、下痢が継続している場合係数を1にすることもあります。下の図を参考にしてください。
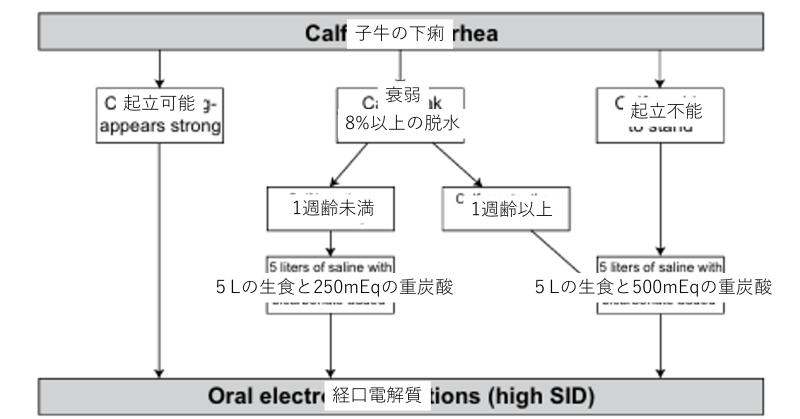
30~60分以内に排尿や沈鬱、脱水の改善、最も注意してほしいのが吸乳反射の改善です。吸乳反射が回復しない場合は敗血症、臍炎、肺炎等を考える必要があります。
輸液選択のプロトコル
まずは、子牛の起立状態や状態を見てみましょう。起立可能か、また衰弱した様子はないかどうかです。次に前章で説明した、眼球陥没の程度や皮膚つまみテスト(図ではテントと表記)、吸乳反射等を確認してください。
静脈内投与を行う場合
補液量=脱水量%×体重Kg
上記の量を最大で80mL/kg/hで投与するが30~50がよく用いられます。(50kg の子牛に対して1時間当たり1.5L~2.5Lの速度)
下の図のフローと基準値を参考にしてみてください。
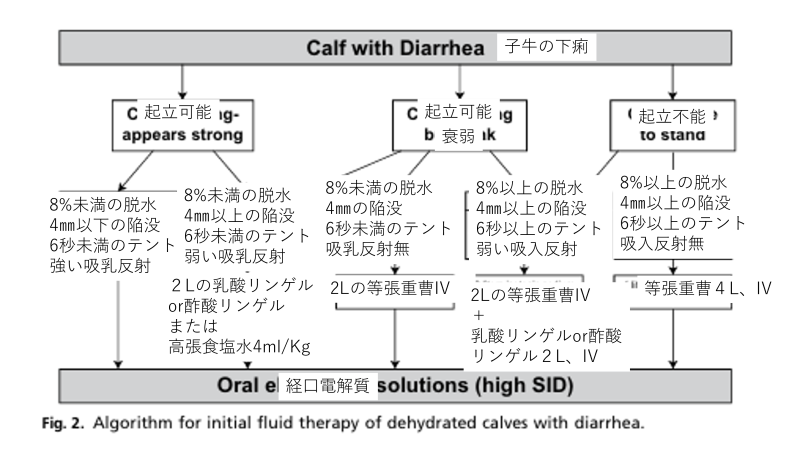
以上が実際に治療を行っていく上で参考にしてほしいことです。はじめの簡易的なプロトコルを基準にし、下の表を参考にしていただけたら良いと思います。経口電解質も輸液療法の一つであり、静脈投与はあくまでも経口での輸液ができない場合、自らミルクが飲めるまでの回復を促すものです。この治療プロトコルを参考により良い子牛の管理、下痢の管理の助けとなれれば幸いです。次の章では、輸液時の注意点を記載しますので、必ず読んでいただきたいです。
2025.02.17
子牛の輸液療法について2(病態の評価)
初めに
前章では、子牛の下痢の病態について書きましたが、この章では実際の病態の評価方法について説明していこうと思います。前章で挙げた病態は、脱水、電解質異常、代謝性アシドーシスでした。今回説明する評価方法は上記3つに関して現場で行うことのできる方法です。
脱水の評価
眼球陥没
眼瞼と眼球の離れ具合を確認する。
皮膚つまみ法
脱水が起きると皮膚の弾力性が低下します。そのため皮膚をつまむと元の戻るまでの時間が長くなります。2秒以内に戻れば正常です。
末梢皮膚温度の低下
脱水が起こると血液の循環が滞ります。そのため四肢にまで血液が回らなくなり、末梢の皮膚の温度が低下してしまいます。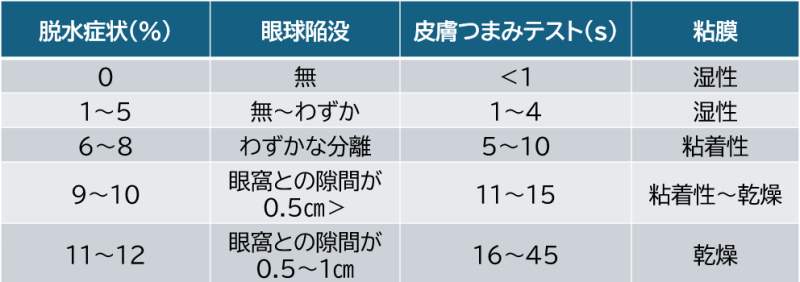
電解質異常の評価
吸乳反射の低下
吸乳反射は子牛が持つ反射行動であり、哺乳ボトルや指を口に当てると吸い始めます。この吸乳反射の低下は脳脊髄液の重炭酸濃度、塩基過剰、血液pHの低下と相関が認められていますので、反射の有無を評価しましょう。
代謝性アシドーシスの評価
脱水の有無にかかわらず、D-乳酸が代謝性アシドーシスの原因です。
中枢神経抑制はD-乳酸の増加によるD-乳酸の基準は2mmol/Lとされており、神経症状などの異常な症状を示す子牛の乳酸は10~11mmol/Lと約4倍の濃度となります。11.0±3.6では子牛は起立不能を示し、比較的健康な子牛では、2.4±2.1となっていました。
D-乳酸は運動失調、起立困難、眼瞼反射の抑制に関係しますので、これらの評価もしていけると良いと思います。
以上が現場で行うことのできる評価方法です。これらを正確に評価していくことで、実際に輸液の内容を考えていくことができます。日々の子牛の観察において少しでも参考にしていただけると良いと思います。次章では、実際の輸液の選択について説明していきます。
2025.02.17
子牛の輸液療法について1(子牛における下痢の病態)
初めに
子牛が起こす下痢は、農家の方にとって大きな問題です。下痢が長引けばその後の増体や最悪の場合、死ぬこともあります。下痢の重篤化を防ぐためには「輸液」による治療を行う必要がある場合があります。これから子牛の下痢と「輸液」についていくつかの章に分けて解説していきたいと思います。
子牛では生後4週間において多く下痢が認められます。原因としてはコロナウイルスやロタウイルス等のウイルス、大腸菌等の細菌、コクシジウムやクリプトスポリジウム等の原虫が考えられます。下痢を呈した子牛の小腸内には原因にかかわらず、大腸菌が増加しており、それに伴い腸粘膜に障害や菌血症を呈することがあります。また、代謝性アシドーシスを引き起こすことがあり、これは脱水を伴うものと伴わないものに分けられるます。
下痢による主な病態
脱水
腸管分泌の増か、水分吸収の減少、腸管通過物の増加により引き起こされます。子牛の体重の75%は水分であり、細胞外液(血液や組織液等)は体重の45%を占めます。成牛よりも割合が高く損失に敏感です。下痢を呈する子牛は一日に13~18%、最大で21%の水分を失うこともあるとされています。
電解質異常
下痢により、水分の損失に伴い、ナトリウムとカリウムの損失が起こる。電解質濃度は、ミルク(水分)の摂取量低下により、血液濃縮が起こり見えにくくなっている場合もあります。上記に加え、血清中のグルコース、クロライドの低下も起こります。そして、完治後10日以内は電解質の不均衡が維持されます。
代謝性アシドーシスとD型乳酸の関係について
下痢を呈した子牛では、腸内細菌の過剰増殖が起こり、それに伴う消化管内の炭水化物の発酵により、D型乳酸が増加します。D型乳酸は代謝性アシドーシスの主な原因であり、運動失調や、中枢神経障害を引き起こします。また、D型乳酸は牛の肝臓ではあまり代謝ができません。
以上が子牛の下痢の主な病態となっています。「輸液」による治療は、脱水、電解質異常、代謝性アシドーシスを補正するために行います。病態を正しく理解することで、正しい治療を行っていけるようにしましょう。
2025.01.21
牛の高病原性鳥インフルエンザの最新情報
皆様
こんにちは、大澤です
本日は、2024年8月にアクセプトされたJDS Communications®より Zelmar Rodriguez et.al Epidemiological and clinical aspects of highly pathogenic avian influenza H5N1 in dairy cattle(乳牛における高病原性鳥インフルエンザH5N1
の疫学的および臨床的側面)の中から最新の高病原性鳥インフルエンザ(HPAI)に関する情報をお伝えします。

私が読んで感じた要点をお伝えします。
この牛のHPAIは人にも感染するリスクがあり、ワンヘルス的考え方必要だと筆者がまとめていました。(ワンヘルスとは「人の健康」「動物の健康」「環境の健全性」を一つの健康と捉え、一体的に守っていくという考え方)
では、実際どのようなことが現場で起こっているのでしょうか。
現場で行われている対策は、移動の制限とバルクスクリーニングによる摘発がおこなわれています。
また、感染牛は症状を示すもの(主に乳量の減少、異常乳)と無症状のものに分けられます。
無症状の個体で今回、乳中にもウイルスを含んでおり、排出されるウイルス量は症状のある個体より多いというデータがでました。また、感染時期によっては、ウイルスの排出がない時期(潜伏期)があり、検査でも発見できない場合があり、実際、牛が移動させてしまうケースもありました。表からも、症例数は増えている(=摘発できている)ように感じます。
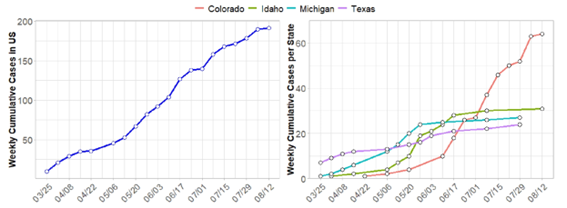
表:2024年3月25日から8月13日までに、米国(左)および高罹患州(右:コロラド州、アイダホ州、ミシガン州、テキサス州)の酪農牛群の週ごとに報告されたHPAI H5N1の累積確認症例(陽性牛群)アメリカ全体で症例数は増えており、コロラド州でも症例頭数が増えていたことがわかります
感染牛に特徴はあるのでしょうか。
APHIS (2024b) の調査によると、「臨床徴候を示した牛の割合は、初産牛で 4%、第 2 産牛で 7%、第 3 産牛以上で 9%であった。さらに、乾乳牛の 5% に臨床徴候が見られたが、離乳前および泌乳していない未経産牛では臨床徴候は検出されなかった。」と報告がありました。また、1歳齢で感染実験(n=4)では口腔咽頭、眼球、唾液のぬぐい液からウイルスRNAが検出された報告があり、一過性の鼻汁が唯一見られた臨床症状でした。
いま、アメリカで検査対象となる牛は臨床症状の有無によって検査が行われており、対象から漏れている牛がいるのかな感じました。
表:防疫対策の3本の柱(文書より図へ)
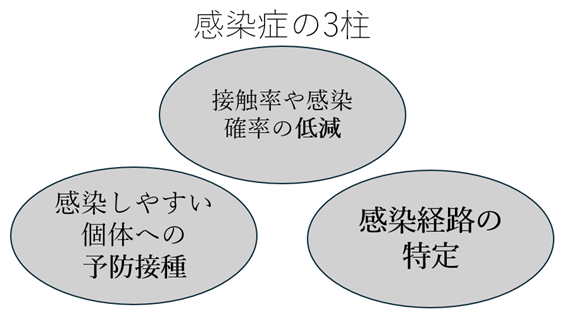
感染症の予防対策ではこの3つの要素が基本となるようです
これから、もし北海道に牛HPAIが入ってきてたら、身近に野生動物が多いため、感染リスクが高いのではと感じています。日本の周辺国では、様々な伝染病が流行しています(アフリカ豚熱、口蹄疫など)。
農場の防疫対策について考えるきっかけになれば幸いです。
2025.01.21
高病原性鳥インフルエンザ 最新情報2025年1月
ゆうべつ牛群管理サービスの大澤です。
最新の高病原性鳥インフルエンザについて紹介します。
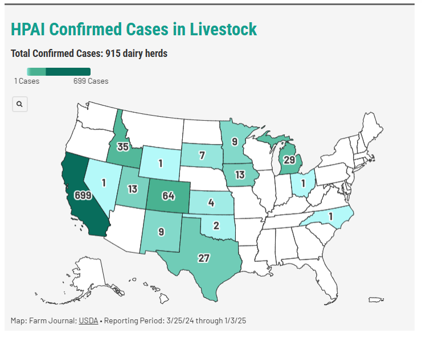
発生状況:アメリカ16州 915牛群で発生が確認されており、カリフォルニア州では「H5N1型鳥インフルエンザへの対応として乳牛および家禽の展示会を新たに禁止」という発表がありました(Bovine Veterinarian 2025.1.9より)(上:アメリカでの各州の牛群で確認されたHPAI発生状況(色が濃いほど発生が多い) 下:現在確認されている野鳥、家禽、搾乳牛群でのHPAI発生状況と確認された州・管轄の数)
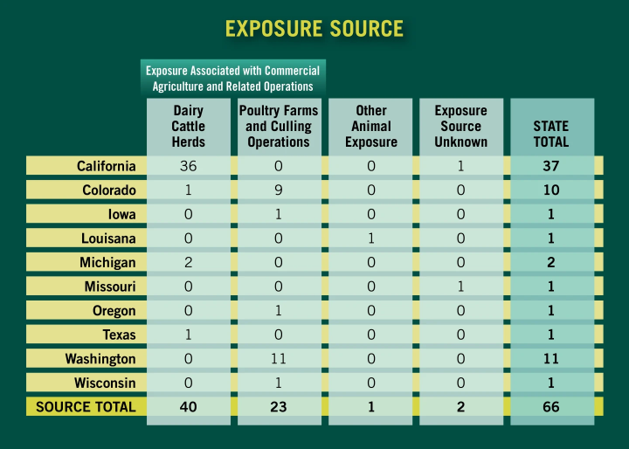
ヒトでの発生も確認されており、66人の感染が確認されており、うち1名がなくなっています(基礎疾患あり、高齢)。HPAIウイルスはヒトへの病原性は低く、一般のヒトへの感染リスクは低いとされています。しかし、ヒトへの感染機会が増えることにより、ヒトへの感染性が高くなる変異を起こすことが懸念されています。(表:ヒトのHPAI感染要因まとめた表、搾乳牛群との接触による感染が40名、家禽との接触による感染が23名)
また、検査の流れが一部変わりました。
酪農生産者が牛群を登録することで毎週のバルク乳検査を行い、3週連続で陰性であった場合、追加検査なしで群れは監視対象の無影響群れのステータスを受け取ります。連邦命令で現在義務付けられている個々の動物の移動事前追加検査なしで、動物を州間で移動させることができます。(登録してない牛群は今までと同じ)
5段階の戦略には以下の流れになってます。
第1段階 – 全国的な集乳をモニタリングし、病気の発生地域を特定し、傾向を監視し、州が感染の可能性がある牛群を特定するのを支援する
第2段階 – 州と協力してバルク乳のサンプリングプログラムを立ち上げ、H5に感染している牛群を特定し、感染していない状態を証明
第3段階 – H5が検出された州において、特定の事例を特定し、強化されたバイオセキュリティ、移動制限、接触追跡調査を含む迅速な対応策を実施
第4段階 – 未感染州におけるバルク乳の継続的なH5存在しないことを証明
第5段階 – 定期的なサンプリングと検査を実施し、全国的な牛群から長期的にH5が存在しないことを証明
という流れになっています(表 USDAより、プログラムのステージごとの内容が記載)。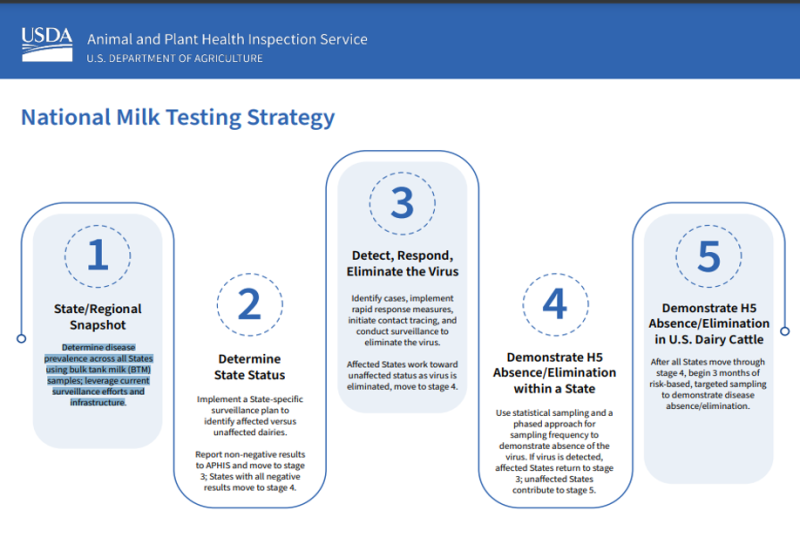
ワクチンに関する最新情報も確認しました。
フェレットでHPAIのmRNAワクチンの接種実験をしたところ、ウイルスの排出量の減少と体重減少が低減されたというデータが出ました。ワクチンの実用化され、感染がコントロールされればと思いました。
最後に、日本のHPAIは家禽、野鳥での発生報告があります。また、HPAIに関するカリフォルニア州の獣医師の報告によると、「現在の健康と管理の問題を増幅させる」と話しています。牛群を健康に管理することと、防疫管理が発生予防と重症化させないうえで重要になっていくのかと考えています。
参考資料:
- Epidemiological and clinical aspects of highly pathogenic avian influenza H5N1 in dairy cattle
- USDAサイトホームより
- CDCサイトホームより
- NIDより


